L'Infarctus du Myocarde Aigu et les besoins médicaux non satisfaits
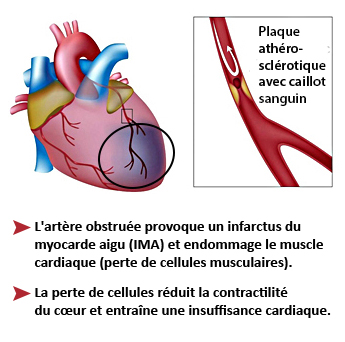
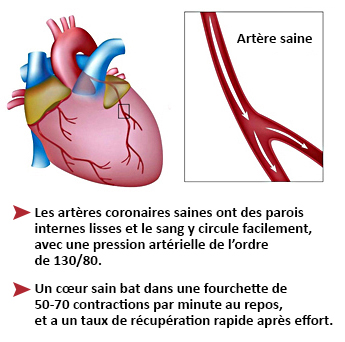
Un infarctus du myocarde aigu (IMA), également appelé « crise cardiaque », est la destruction d’une zone plus ou moins étendue du muscle cardiaque. Il est le plus souvent la conséquence de l’obstruction d’une artère coronaire par formation de plaques d’athérome liées à l’accumulation progressive de cholestérol (graisse) sur ses parois. L’IMA survient lorsqu’une plaque athéromateuse se détache, se déplace et se retrouve piégée dans une artère coronaire. Un caillot de sang se forme autour de la plaque et interrompt l’apport sanguin, privant d’oxygène la zone cardiaque en aval de l’obstruction, qui va alors se nécroser et mourir.
Epidémiologie et besoins médicaux non satisfaits
En France, en moyenne, 80 000 personnes sont victimes d’une crise cardiaque chaque année, dont environ 12 000 vont mourir rapidement:
- Une personne sur 10 meurt dans l’heure qui suit.
- Le taux de mortalité est ensuite de 15% la première année. Néanmoins, ce taux baisse progressivement depuis plusieurs années du fait de la rapidité et la qualité d’intervention des équipes de secours (à condition qu’elles soient appelées rapidement), des progrès de la thérapeutique d’urgence, et de la disponibilité et de l’efficacité croissante des unités de cardiologie interventionnelle.
Cependant, en cas d’infarctus massif (environ 30% des cas), dont la sévérité dépend aussi de sa localisation, une insuffisance cardiaque chronique va s’installer et progressivement et irrémédiablement s’aggraver au fil des ans, entrainant la mort de 50% de ces patients dans les 5 ans suivant l’IMA en dépit des thérapeutiques conventionnelles disponibles, qui sont essentiellement symptomatiques.
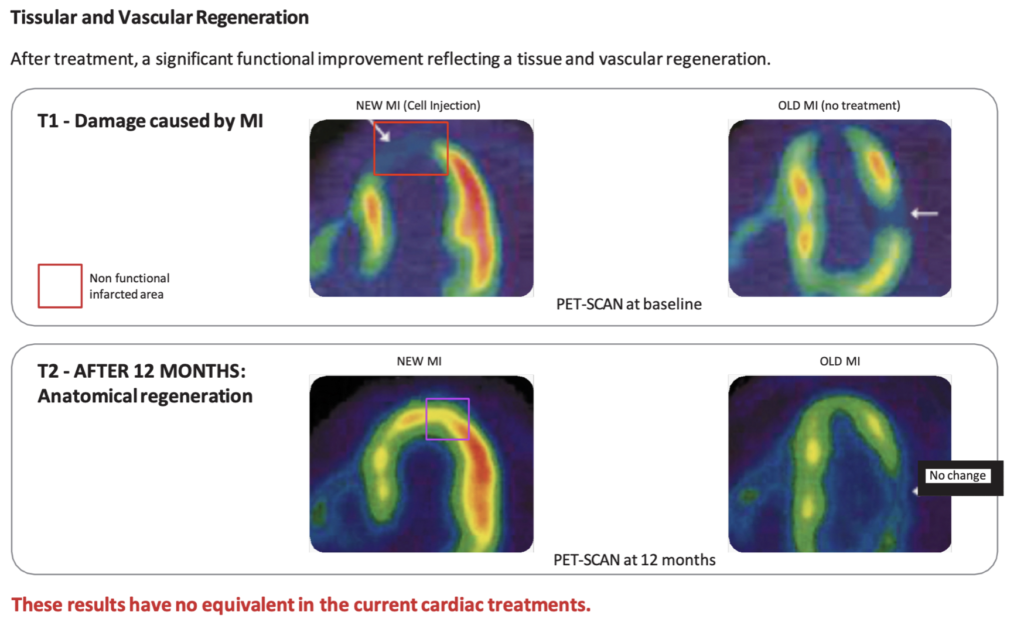
L’insuffisance cardiaque post-infarctus représente donc un besoin médical crucial non satisfait jusqu’à ce jour.
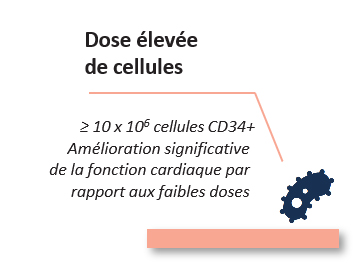
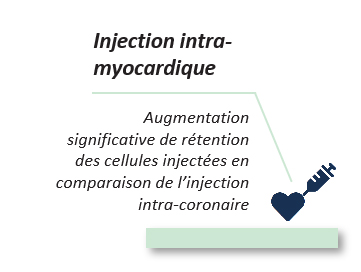
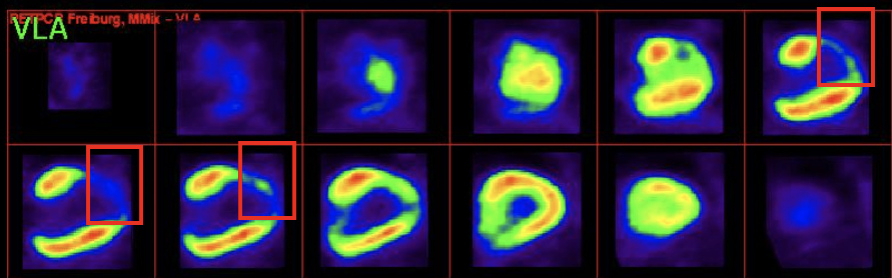
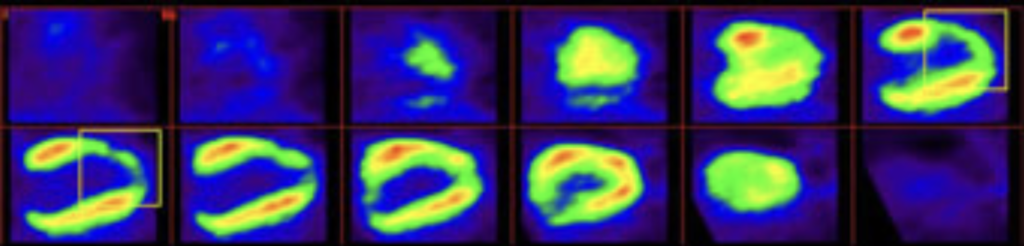
La médecine régénératrice émerge alors comme une révolution médicale pouvant apporter une solution préventive à l’insuffisance cardiaque post-infarctus en régénérant anatomiquement et fonctionnellement la zone cardiaque lésée.